Meu SciELO
Serviços Personalizados
Artigo
Indicadores
 Citado por SciELO
Citado por SciELO
Links relacionados
 Similares em SciELO
Similares em SciELO
Bookmark
ComCiência
versão On-line ISSN 1519-7654
ComCiência no.162 Campinas out. 2014
ARTIGO
Panorama do desenvolvimento tecnológico em vacinas no Brasil
Akira Homma; Cristina A. Possas; Reinaldo M. Martins
A vacinação de doenças imunopreveníveis é considerada como uma das atividades de maior impacto em saúde pública e de melhor custo-benefício. Os resultados são tão impactantes que a Organização Mundial da Saúde considera que somente a água potável é superior às atividades de prevenção de doenças por vacinas.
Aproveitando a euforia da grande conquista da erradicação da varíola no país, o Brasil criou, em 1973, o Programa Nacional de Imunizações (PNI) do Ministério da Saúde, com apenas 6 vacinas no calendário básico. Desde então, todos os governos apoiaram o fortalecimento do PNI, e hoje, graças ao envolvimento de profissionais altamente competentes e a adoção de estratégias e procedimentos muito efetivos, o programa brasileiro é reconhecido internacionalmente como um dos mais efetivos e completos, alcançando altas coberturas de vacinação, com resultados de grande impacto, como a erradicação da poliomielite e sarampo, e redução significativa de notificações de todas outras doenças imunopreveníveis.
Quase todas as vacinas existentes no mercado internacional já foram incorporadas na rotina do PNI, para o que foi crucial a contribuição de produtores públicos nacionais, como Bio-Manguinhos/Fiocruz e o Instituto Butantan, entre outros. Entre as vacinas incorporadas estão as de rotavirus, pneumococos conjugada, meningite meningocócica sorogrupo C conjugada, influenza, HPV e, no corrente ano, hepatite A – todas de alto custo e de alta complexidade tecnológica. O PNI, em face de seriedade, competência e qualidade dos resultados obtidos, tem merecido alta confiabilidade da população em geral e das sociedades cientificas e médicas especializadas.
Em 1980, com a crise de produção e desabastecimento de soros imunes contra venenos de ofídios e vacinas, o Ministério da Saúde criou o Programa Nacional de Auto-suficiência em Imunobiológicos (Pasni), investindo de forma contínua, em mais de uma década, cerca de US$ 100 milhões na modernização e aumento da capacidade de produção. Essa clara definição de prioridade pelo governo brasileiro, na ocasião, foi muito importante para o país. Possibilitou a ampliação da capacidade tecnológica instalada, tornando-a capaz de atender à demanda de insumos estratégicos como vacinas. Esta política, além de possibilitar a regulação de preços e evitar o desabastecimento, tem efeito multiplicador, demandando novas tecnologias e abrindo o mercado interno para novos insumos, equipamentos e profissionais de alta qualificação.
Nesse contexto de busca do domínio tecnológico na produção nacional de imunobiológicos com o objetivo de acelerar a incorporação tecnológica de novas vacinas, destacou-se a politica do uso do poder de compra público pelo Ministério da Saúde, adotada por diferentes governos como política de Estado. Essa utilização do poder de compra governamental no SUS é uma política que atrela a incorporação de novas vacinas à obrigatoriedade do detentor da tecnologia de produção de transferir a tecnologia em um prazo adequado para a sua incorporação pelo laboratório nacional. A adoção dessa política vem permitindo aos laboratórios nacionais, notadamente a Bio-Manguinhos/Fiocruz e ao Instituto Butantan, a incorporação rápida de novas tecnologias de produção de importantes vacinas para o PNI. No entanto, estes dois laboratórios, além da produção, realizam também atividades de desenvolvimento de novas vacinas, como contra a dengue, malária, leishmaniose, novas vacinas combinadas e outras.
Cabe, contudo, destacar que, apesar dessas conquistas, precisamos avançar muito mais na inovação e no desenvolvimento tecnológico, criando um ambiente institucional e regulatório propício à emergência da inovação. As atividades de desenvolvimento tecnológico e de inovação são, por definição, atividades de longo prazo, com várias etapas, que requerem equipes multidisciplinares, instalações específicas para cada etapa, além do seu alto custo e retorno incerto do investimento. Essas características intrínsecas ao desenvolvimento de uma nova vacina torna essa atividade muito complexa, exigindo estratégias bem definidas de governança, incluindo financiamento a longo prazo, coordenação e gestão profissional especificamente desenhadas para assegurar a viabilidade e continuidade dos projetos.
Para a emergência da inovação é necessária também uma estratégica colaborativa bem definida na pesquisa científica e tecnológica. No país, e mesmo na maioria de outros países em desenvolvimento, não existe nenhuma instituição com capacidade científica e tecnológica para realizar todas as etapas de desenvolvimento, desde a descoberta, realização da pesquisa translacional, até chegar ao produto final. Isto se deve à carência de profissionais com experiência para as diferentes etapas de desenvolvimento e à falta de estruturas voltadas, sobretudo, às etapas finais. Estas requerem instalações com normas de boas práticas de laboratório e voltadas à produção de lotes experimentais para estudos clínicos e requerem também o atendimento a boas práticas de fabricação, além das normas de biossegurança. Em sequência, apresentamos a Figura 1, em que essas diferentes etapas podem ser vistas. Cabe observar que uma nova descoberta é um processo cumulativo que pode requerer muitos anos de investimento contínuo em pesquisa básica e desenvolvimento tecnológico.
Nessas primeiras etapas, até os estudos pré-clínicos, a preocupação maior é a busca da prova de conceito, a partir de estudos laboratoriais em animais. No estudo pré-clínico, busca-se demonstrar dois aspectos importantes para o projeto seguir adiante, que é a segurança do material e a imunogenicidade, antes de ser aplicado em seres humanos. Os estudos pré-clínicos requerem animais sanitária e geneticamente controlados e certificados, além de grandes investimentos em recursos humanos especializados e instalações, constituindo-se, certamente por esta razão, em um dos principais gargalos para o processo de inovação e desenvolvimento tecnológico em imunobiológicos em nosso país. Deve ser ressaltado que, pelos motivos apontados e por sua alta complexidade, os estudos pré-clínicos acabam, em nosso país, restringindo-se a pequenos grupos, com experiência ainda restrita. Por essa razão, o desenvolvimento de recursos humanos nessa área é crucial e deve passar por centros especializados e de excelência em outros países. A superação desses gargalos está, portanto, diretamente ligada à valorização do profissional envolvido e requer uma forte ação indutora do Estado, devendo necessariamente integrar um plano estratégico de longo prazo.
Uma vez obtida a prova de conceito, os resultados do projeto devem mostrar a possibilidade de escalonamento de produção (scale-up) e a transformação do produto em insumo aplicável à saúde pública.
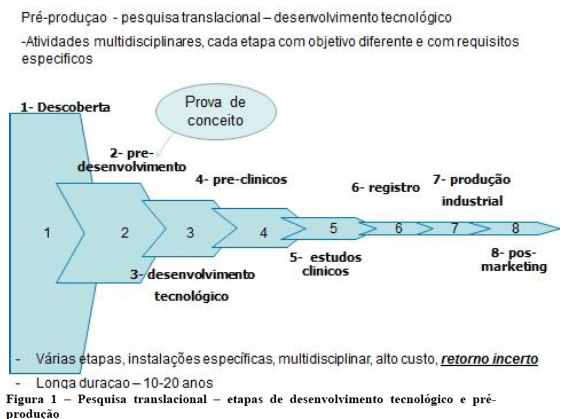
Por outro lado, existe uma falta de compreensão dessa complexidade e dos gargalos existentes, por parte das agências de financiamento, para analisar e contemplar o conjunto das atividades de desenvolvimento tecnológico, sendo muito escassos no país os grupos financiados para ações específicas de inovação e desenvolvimento tecnológico.
Considerações finais
É necessário que o governo brasileiro e as agências de fomento definam novas estratégias que permitam situar o Brasil de forma mais adequada e competitiva no cenário internacional. Este cenário vem sendo marcado pelo acelerado avanço em campos diversos relacionados à áreas de fronteira, como, entre outras, a biotecnologia, com expressivas mudanças nos paradigmas tecnológicos, com a emergência de produtos inovadores em novas plataformas de geração de conhecimentos e tecnologias.
O Brasil tem razoável capacidade instalada para produção de vacinas. Bio-Manguinhos/Fiocruz e o Instituto Butantan já atendem a 90% das demandas do setor público por vacinas no país. Neste contexto, Bio-Manguinhos vem investindo no desenvolvimento e produção de kits para diagnóstico laboratorial de ponta, e tem fornecido para o kit NAT (Nuclear Acid Testing) a todos os bancos de sangue do país, o teste rápido para diagnóstico de HIV e de outras doenças infecto-contagiosas.
Para avançar nesse processo será necessário, também, além dos investimentos, superar outras importantes barreiras na área da regulação, no âmbito da Conep e da Anvisa, assegurando agilidade na avaliação da ética e de procedimentos dos estudos clínicos. Essas avaliações devem considerar a complexidade e a especificidade dos requerimentos exigidos para o desenvolvimento desses produtos inovadores, sendo fundamental assegurar a simplificação dos procedimentos. Finalmente, cabe destacar a importância crucial de um plano estratégico nacional para os próximos 20 anos, voltado à superação de lacunas em campos diversos relacionados à inovação e ao desenvolvimento tecnológico em imunobiológicos, como, entre outros, a revisão e atualização das leis que regem a propriedade intelectual no país.
Akira Homma é
presidente do Conselho Político e Estratégico de Bio-Manguinhos/Fiocruz;
Cristina Possas é
assessora científica sênior de Bio-Manguinhos/Fiocruz;
Reinaldo M. Martins é assessor científico sênior de
Bio-Manguinhos/Fiocruz.