Mi SciELO
Servicios Personalizados
Articulo
Indicadores
 Citado por SciELO
Citado por SciELO
Links relacionados
 Similares en SciELO
Similares en SciELO
Bookmark
ComCiência
versión On-line ISSN 1519-7654
ComCiência no.130 Campinas 2011
ARTIGO
Nanocatálise: aspectos fundamentais e aplicações
Por Nielson F.P. Ribeiro e Mariana M.V.M. Souza
Hoje em dia, a catálise é um dos pilares de sustentação da vida moderna com um grande número de processos químicos e bioquímicos, que são essenciais ao nosso estilo de vida. A maioria dos processos de produção utiliza catalisadores em pelo menos uma das etapas da fabricação. Estima-se que atualmente 20 a 30% de toda a produção industrial é dependente da catálise. Ela está presente nos mais variados campos de atuação da indústria química, com destaque para a produção de combustíveis e biocombustíveis, petroquímica, fertilizantes, tintas, solventes, lubrificantes, fibras e polímeros; na área ambiental, para o controle de emissões poluentes nas indústrias e veículos automotores; ou ainda na produção de fármacos e na indústria alimentícia.
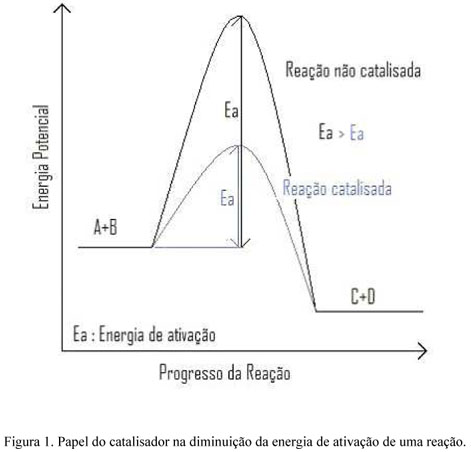
Primeiramente, devemos recordar alguns conceitos básicos de catálise. Catalisador é uma substância que aumenta a velocidade de uma reação química sem ser consumido pela mesma. O catalisador atua diminuindo a energia de ativação da reação, ou seja, ele diminui a barreira de energia que impede que a reação ocorra. A Figura 1 mostra o papel do catalisador na diminuição da energia de ativação de uma reação. Na catálise dois parâmetros estão sempre sendo avaliados: a atividade catalítica, que mede a conversão, a taxa de transformação dos reagentes em produtos, e a seletividade, que mede a produção do produto desejável frente aos produtos indesejáveis.
Tradicionalmente, existem dois tipos de catálise: a homogênea e a heterogênea. Na catálise homogênea os reagentes, produtos e catalisador estão dispersos em uma única fase, normalmente líquidos. Por exemplo, a produção de biodiesel, que consiste numa transesterifícação (reação química que pode ocorrer entre um éster e um álcool ou entre um éster e um ácido, sempre tendo a formação de um novo éster) do óleo vegetal com um álcool utilizando um catalisador ácido. Já na catálise heterogênea os reagentes, produtos e catalisador estão em fases diferentes. Normalmente o catalisador é sólido e os reagentes/produtos são líquidos ou gasosos.
A catálise heterogênea é um fenômeno superficial, ou seja, a reação ocorre na superfície do catalisador e é altamente dependente da área disponível. Além disso, sempre estão envolvidas ao menos três etapas: adsorção dos reagentes na superfície do catalisador (formação de uma ligação química entre os reagentes e catalisador), reação entre as espécies adsorvidas no catalisador, e dessorção (liberação) dos produtos formados e reagentes não convertidos.
A catálise homogênea apresenta como maiores vantagens a alta atividade catalítica (todos os sítios catalíticos, lugares para ocorrer a reação, estão acessíveis aos reagentes pois o catalisador está solubilizado no meio reacional) e alta seletividade. As principais desvantagens são a dificuldade de separação do catalisador do produto final, podendo haver problemas na purificação do produto.
Os catalisadores heterogêneos exibem em geral menor atividade, pois somente os sítios na superfície estão acessíveis aos reagentes. Além disso, pode haver desativação dos sítios ativos seja por uma sinterização (aglomeração das partículas) ou deposição de resíduos carbonáceos. A grande vantagem da catálise heterogênea é a maior facilidade de recuperação e reutilização do catalisador.
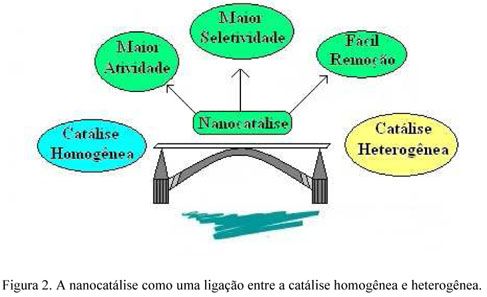
E a nanocatálise? A nanocatálise faz uma ponte, uma ligação entre a catálise homogênea e a heterogênea (Figura 2), permitindo combinar as vantagens de ambas. Os nanocatalisadores têm alta área superficial, aumentando o contato entre os reagentes e a superfície do catalisador, permitindo um grande aumento da atividade catalítica. Por outro lado, são facilmente separáveis do meio reacional devido a sua insolubilidade.
Nanocatalisadores são catalisadores feitos átomo por átomo e são produzidos de maneira controlada. A produção átomo por átomo permite controlar sua atividade e seletividade por ajuste no tamanho da partícula (efeito de superfície) e grau de carregamento da partícula (efeito eletrônico), o que leva a propriedades físicas e químicas sem equivalência aos materiais mássicos.
A nanotecnologia engloba o desenvolvimento de materiais que possuem pelo menos uma de suas dimensões na ordem de 10-9 metro (1 nm = 10-9 m, que significa 1/1.000.000.000 m). Apesar da nanotecnologia estar presente em diversas áreas da natureza há milhares de anos, foi na década de 1950 que o físico americano Richard Feynman sugeriu a manipulação dos átomos para construção de produtos com propriedades únicas. A catálise heterogênea, mesmo que intuitivamente, é provavelmente a área mais antiga da nanotecnologia. Há muito tempo sabe-se que a catálise é um fenômeno de superfície, que ocorre nas dimensões do tamanho de um cristal, de um ligante de composto de coordenação, de um centro ativo enzimático etc. Portanto, sempre se buscou a produção de catalisadores com o menor tamanho de partícula possível. Mas o que diferencia a catálise heterogênea tradicional da nanocatálise? A nanocatálise envolve o desenvolvimento de um catalisador com propriedades únicas, propriedades que só existem no estado nanométrico, e essas propriedades estão relacionadas aos efeitos de superfície e efeitos eletrônicos.
Em relação ao efeito de superfície, é fácil compreender que a diminuição do tamanho de partícula leva ao aumento da fração de átomos situados na superfície do material e, consequentemente, um aumento da área específica desse material (ou seja, quantos m2 por grama o material exibe). Por exemplo, uma partícula de 3 nm de diâmetro possui cerca de 50% dos átomos na superfície, já uma partícula com 20 nm apresenta somente 10% dos átomos na superfície. Além disso, ao se variar o tamanho da partícula, varia-se a proporção entre os átomos situados nas faces e arestas dos cristais e pode-se também provocar alterações na estrutura cristalina, o que trará consequências diretas sobre a atividade catalítica.
O efeito eletrônico refere-se a variações na estrutura eletrônica de um material em função do tamanho de partícula. Um átomo possui níveis energéticos discretos que podem ser ocupados pelos elétrons, ou seja, as energias dos elétrons são quantizadas. Em um macrosólido os átomos estão próximos uns dos outros e os elétrons de um átomo são influenciados pelos elétrons e núcleos de átomos adjacentes. Essa influência é tal que cada estado atômico distinto pode se dividir em uma série de estados eletrônicos proximamente espaçados no sólido, para formar o que é conhecido por banda de energia eletrônica. Para materiais nanométricos, à medida que ocorre o decréscimo do tamanho da partícula, ocorre o desaparecimento da estrutura de bandas e os níveis eletrônicos tornam-se discretos, dando propriedades únicas a esses materiais. Estas propriedades variam enormemente e podem ser ajustadas de acordo com o tamanho de partícula.
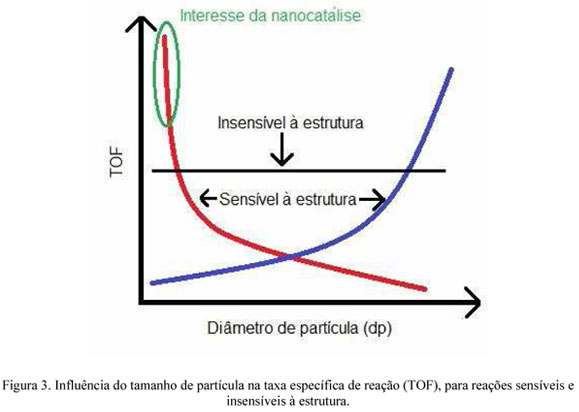
Essas duas características das nanopartículas fazem com que o tamanho e a forma da partícula exerçam influência direta sobre a atividade e seletividade do catalisador. Existem dois tipos de reação em relação à influência do tamanho de partícula: reações sensíveis ou insensíveis à estrutura do catalisador. Uma reação é sensível à estrutura quando a taxa de reação por sítio ativo (TOF, turnover frequency) varia com o tamanho da partícula. Essa variação pode se dar em dois sentidos diferentes. No primeiro, o TOF diminui quando as partículas diminuem, ou seja, as partículas grandes são mais ativas que as pequenas. Nesse caso a reação requer sítios adjacentes ou situados em faces planas para que a adsorção/reação dos reagentes possa ocorrer. No segundo, o TOF aumenta com o decréscimo do tamanho das partículas. Nesse caso, os sítios ativos são os de baixa coordenação, que são relativamente mais abundantes em partículas pequenas. O interesse nos nanocatalisadores está justamente neste último caso. A Figura 3 ilustra melhor esse fenômeno.
O exemplo mais comum da nanocatálise é a utilização do ouro como catalisador. O ouro é frequentemente considerado o mais nobre (inerte) de todos os metais. Por isso, durante muitos anos, as partículas de ouro foram caracterizadas por apresentarem baixa atividade catalítica. O interesse na utilização do ouro como catalisador começou no final da década de 80 com os trabalhos de Masatake Haruta1, que indicaram, pela primeira vez, que para o ouro ser um catalisador ativo é necessário que esteja na forma de nanopartículas (d< 10nm) bem dispersas sobre um suporte óxido. O aperfeiçoamento das técnicas de preparo e caracterização tornou possível confeccionar catalisadores de ouro nanosuportados (diâmetro médio das partículas de ouro variando entre 2-10 nm), que proporcionaram avanços significativos em termos atividade e seletividade catalítica. A atividade dos catalisadores de ouro é fortemente dependente do tamanho das partículas, da natureza do suporte e das propriedades da interface metal-suporte. Dessa forma, uma criteriosa escolha do método de preparação torna-se fundamental para a obtenção de catalisadores com alta atividade e para o entendimento da relação entre estrutura e atividade catalítica.
Existem diferentes métodos de preparo de nanocatalisadores de ouro, sendo que o mais empregado é o método da deposição/precipitação. Neste método utiliza-se um precursor de ouro clorado e faz-se sua precipitação com uma solução básica, em geral soda cáustica (NaOH). As nanopartículas de ouro são formadas em solução e se depositam sobre a superfície do catalisador. As principais variáveis de controle do método são a temperatura, pH da solução precursora, que determina o tipo de complexo de ouro a ser depositado, a concentração da solução e o ponto isoelétrico do suporte. O ponto isoelétrico mede as cargas superficiais do suporte, determinando se o suporte possui carga positiva, neutra ou negativa. Para uma boa deposição, o pH da solução deve estar na faixa entre 5 e 8, que proporciona o aparecimento de um complexo de ouro negativo, livre de cloro, com o suporte carregado positivamente. A atração entre as cargas negativas do complexo e as cargas positivas do suporte permite a deposição das partículas de ouro.
Uma das principais aplicações dos catalisadores à base de ouro é na reação de oxidação seletiva do CO. Esta reação consiste na oxidação do monóxido de carbono (CO) em uma corrente reacional rica em hidrogênio, onde se deseja oxidar o CO sem oxidar o H2. É uma etapa fundamental na purificação de correntes de hidrogênio para a alimentação de células a combustível, já que o CO é um poderoso veneno para os eletrodos das células. A reação de oxidação do CO sobre catalisadores de ouro é sensível à estrutura e assim a atividade catalítica depende fortemente do tamanho da partícula de ouro que, por sua vez, é função do método de preparo e do suporte utilizado. Óxidos que apresentam maior mobilidade do oxigênio, como TiO2 ou CeO2, em geral proporcionam melhores resultados como suporte para as nanopartículas de ouro do que óxidos irredutíveis, como SiO2 ou Al2O3, pois o oxigênio do suporte participa da oxidação do CO adsorvido nas partículas de ouro.
Atualmente as nanopartículas de ouro são empregadas em diversas reações catalíticas, como a oxidação de hidrocarbonetos, oxidação do etanol, redução de óxidos de nitrogênio, decomposição de aminas e compostos orgânicos halogenados, entre outras. Como vantagens dos nanocatalisadores de ouro, além de sua atividade em baixas temperaturas e seletividade, destaca-se também o menor preço do ouro no mercado internacional quando comparado a outros metais nobres (o ouro custa cerca de U$ 7/g enquanto a platina chega a custar U$ 14/g).
Como conclusão, os nanocatalisadores, devido às suas propriedades únicas em termos de elevada área superficial e distribuição eletrônica, representam uma grande promessa e oportunidade para novas aplicações na indústria química, permitindo ganhos de atividade e seletividade em relação aos catalisadores tradicionais. Dificuldades de preparação e caracterização desses materiais tendem a ser vencidas com o tempo, abrindo as portas para aplicações em larga escala.
Referência bibliográfica:
1. Haruta M., Yamada N., Kobayashi T., Iijima S., "Gold catalysts prepared by coprecipitation for lowtemperature oxidation of hydrogen and of carbon monoxide", Journal of Catalysis, vol. 115, pp. 301-309, 1989.
Nielson F.P. Ribeiro e Mariana M.V.M. Souza são professores da Escola de Química, Centro de Tecnologia. Universidade Federal do Rio de Janeiro (UFRJ).